Introducción
La bioética se ha consolidado como una disciplina imprescindible en el análisis contemporáneo de los dilemas que surgen en el ámbito de la medicina, las ciencias de la vida y las políticas de salud. El vertiginoso avance científico y tecnológico plantea interrogantes que no pueden resolverse únicamente desde el saber técnico, sino que requieren una reflexión moral profunda y sistemática.
Siguiendo la definición de Juan Carlos Mainetti (1990), la bioética es el “estudio sistemático de la conducta humana en el área de las ciencias de la vida y la atención de la salud, en tanto que dicha conducta es examinada a la luz de los principios y valores morales”. Esta concepción pone en el centro a la persona humana, su dignidad y sus derechos, como eje de toda decisión sanitaria.
¿Qué es la bioética?
La bioética es un campo interdisciplinario que analiza las cuestiones éticas derivadas de la práctica médica, la investigación científica, la biotecnología y las políticas públicas de salud. Su finalidad es reflexionar críticamente sobre los impactos de los avances científicos en los seres humanos, considerando no solo aspectos biológicos, sino también sociales, culturales, jurídicos y morales.
No se trata de un conjunto rígido de normas, sino de un espacio de deliberación racional orientado a la toma de decisiones prudentes, responsables y respetuosas de los derechos humanos fundamentales.
Historia de la bioética
Si bien las preocupaciones éticas en medicina existen desde la Antigüedad —como lo demuestran el Código de Hammurabi, las regulaciones médicas en Egipto o el Juramento Hipocrático—, la bioética como disciplina autónoma surge en la segunda mitad del siglo XX.
En la década de 1970, el bioquímico y oncólogo estadounidense Van Rensselaer Potter acuñó el término “bioética”, concibiéndolo como un puente entre las ciencias biológicas y los valores humanos, capaz de garantizar la supervivencia y la calidad de vida de la humanidad. Desde entonces, la bioética se nutrió de diversas corrientes filosóficas, incluyendo el pensamiento clásico (Platón y Aristóteles), la escolástica (Tomás de Aquino), el utilitarismo, el pragmatismo y corrientes críticas contemporáneas.
Su desarrollo estuvo estrechamente ligado a hechos históricos que pusieron en evidencia graves vulneraciones éticas, como los experimentos médicos no consentidos durante la Segunda Guerra Mundial, lo que dio lugar a documentos fundamentales como el Código de Núremberg y, posteriormente, la Declaración de Helsinki.
Principios básicos de la bioética
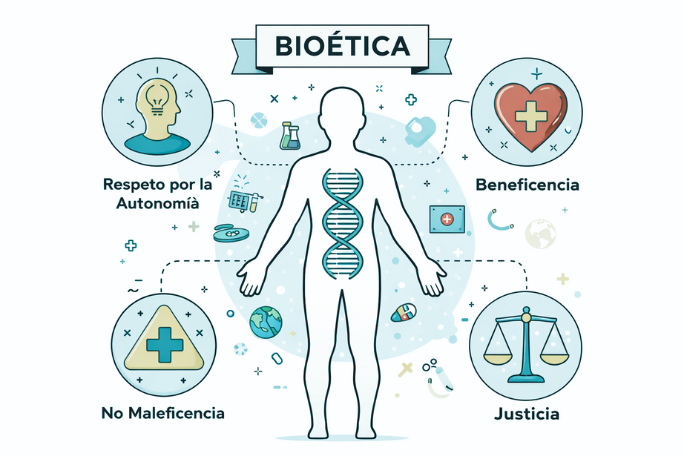
La bioética contemporánea se apoya en cuatro principios fundamentales, ampliamente aceptados como marco de referencia para el análisis ético:
1. Respeto por la autonomía
Reconoce el derecho de toda persona a tomar decisiones libres e informadas sobre su propia salud y su cuerpo, sin coerción ni interferencias indebidas.
2. Beneficencia
Impone la obligación de actuar en beneficio del paciente o de la persona involucrada, promoviendo su bienestar y maximizando los posibles beneficios de las intervenciones.
3. No maleficencia
Establece el deber de no causar daño intencionalmente, sintetizado en el clásico principio médico primum non nocere.
4. Justicia
Exige una distribución equitativa de los recursos sanitarios, un trato imparcial y la igualdad en el acceso a la atención de la salud.
Estos principios no operan de manera aislada, sino que deben ponderarse en conjunto ante cada situación concreta.
Comités de bioética
Los comités de bioética son órganos colegiados cuya función principal es analizar, deliberar y emitir recomendaciones sobre conflictos éticos relacionados con la práctica asistencial, la investigación en seres humanos y la aplicación de nuevas tecnologías.
Están integrados por profesionales de diversas disciplinas, entre ellos:
- Médicos y otros profesionales de la salud
- Investigadores
- Filósofos y bioeticistas
- Abogados
- Sociólogos
- Representantes de la comunidad
Esta composición plural garantiza una mirada integral y evita decisiones basadas exclusivamente en criterios técnicos o corporativos.
Temas tratados por los comités de bioética
Los comités de bioética abordan una amplia variedad de dilemas éticos, entre los que se destacan:
- Consentimiento informado y respeto de la autonomía del paciente
- Investigación en seres humanos y protección de los participantes
- Uso de tecnologías reproductivas y fertilización asistida
- Manipulación genética y estudios con células madre
- Donación y trasplante de órganos
- Decisiones al final de la vida, limitación del esfuerzo terapéutico y cuidados paliativos
- Acceso equitativo a los servicios de salud y asignación de recursos escasos
Estos temas reflejan la complejidad creciente de la medicina moderna y la necesidad de marcos éticos sólidos para su abordaje.
Casos bioéticos internacionales de relevancia histórica
El desarrollo de la bioética no puede comprenderse sin el análisis de casos concretos que evidenciaron vulneraciones éticas graves o dilemas morales complejos. Algunos de los ejemplos más relevantes a nivel internacional son los siguientes:
1. El estudio de sífilis de Tuskegee (Estados Unidos, 1932–1972)
Este estudio observacional, llevado a cabo por el Servicio de Salud Pública de Estados Unidos, investigó la evolución natural de la sífilis en hombres afroamericanos pobres, sin informarles su diagnóstico ni ofrecerles tratamiento, aun cuando la penicilina ya estaba disponible.
Este caso se convirtió en un símbolo de violación de la autonomía, la beneficencia y la justicia, y fue determinante para la creación de regulaciones éticas estrictas en investigación clínica, incluyendo el Informe Belmont.
2. El Código de Núremberg y los juicios médicos (Alemania, 1947)
Tras la Segunda Guerra Mundial, los juicios de Núremberg revelaron experimentos médicos realizados en prisioneros sin consentimiento, con resultados frecuentemente letales.
De estos procesos surgió el Código de Núremberg, que estableció principios fundamentales como el consentimiento voluntario y la proporcionalidad entre riesgos y beneficios, constituyendo uno de los pilares históricos de la bioética moderna.
3. El caso de Henrietta Lacks y las células HeLa (Estados Unidos, década de 1950)
Las células tumorales de Henrietta Lacks fueron extraídas sin su consentimiento informado y utilizadas para investigaciones que revolucionaron la biomedicina.
Este caso abrió debates centrales sobre consentimiento informado, propiedad de muestras biológicas, justicia distributiva y derechos de los pacientes, debates que continúan vigentes en la investigación genética contemporánea.
4. La clonación de la oveja Dolly (Reino Unido, 1996)
El nacimiento de Dolly, el primer mamífero clonado a partir de una célula somática adulta, generó un debate bioético global sobre los límites de la manipulación genética, el bienestar animal y la posibilidad de clonación humana.
Este caso impulsó declaraciones internacionales, como la Declaración Universal sobre el Genoma Humano y los Derechos Humanos de la UNESCO, que prohíbe la clonación reproductiva humana por atentar contra la dignidad humana.
5. Casos de final de vida: Karen Ann Quinlan y Terri Schiavo (Estados Unidos)
Estos casos emblemáticos abordaron el derecho a rechazar tratamientos médicos, la limitación del esfuerzo terapéutico y la autonomía del paciente en estados vegetativos persistentes.
Contribuyeron decisivamente al desarrollo del concepto de voluntades anticipadas y al reconocimiento ético y legal de los cuidados paliativos y la muerte digna.
Conclusión
La bioética constituye hoy una herramienta indispensable para orientar la toma de decisiones en el ámbito de la medicina y las ciencias de la vida. Surgida como respuesta a los abusos y dilemas generados por el progreso científico, se apoya en principios éticos universales que buscan proteger la dignidad humana.
Los comités de bioética, con su enfoque interdisciplinario, cumplen un rol clave en la evaluación de situaciones complejas, pr A continuación incorporo ejemplos emblemáticos de casos bioéticos internacionales, integrados de manera académica al artículo, y agrego bibliografía científica formal en formato Vancouver (el más utilizado en ciencias de la salud y medicina legal). Si luego prefiere formato APA, puedo convertirlo sin dificultad.
Bibliografía
- Gracia D. Fundamentos de bioética. Madrid: Triacastela; 2008.as fuentes que consultaste sobre el caso bioético de la clonación de la oveja dolly Reply in Español
- Potter VR. Bioethics: Bridge to the Future. Englewood Cliffs: Prentice-Hall; 1971.
- Beauchamp TL, Childress JF. Principles of Biomedical Ethics. 8th ed. New York: Oxford University Press; 2019.
- Mainetti JA. Bioética: una nueva disciplina. La Plata: Quirón; 1990.
- National Commission for the Protection of Human Subjects of Biomedical and Behavioral Research. The Belmont Report. Washington DC: U.S. Government Printing Office; 1979.
- World Medical Association. Declaration of Helsinki: Ethical Principles for Medical Research Involving Human Subjects. JAMA. 2013;310(20):2191–2194.
- UNESCO. Declaración Universal sobre el Genoma Humano y los Derechos Humanos. París: UNESCO; 1997.
- Jones JH. Bad Blood: The Tuskegee Syphilis Experiment. New York: Free Press; 1993.
- Skloot R. The Immortal Life of Henrietta Lacks. New York: Crown Publishing Group; 2010.
- Emanuel EJ, Emanuel LL. Four models of the physician-patient relationship. JAMA. 1992;267(16):2221–2226.