Síndrome Cervicobraquial
El Síndrome Cervicobraquial (SCB), es una de las patologías, por no decir la más frecuente de las patologías que causa un verdadero problema a la ley de Riesgo del Trabajo y una de sus grietas más profundas. Es una de las principales causas que alimentan a la industria del juicio por enfermedades profesionales. No está incluida como tal en ninguna otra lista de enfermedades profesionales de otros organismos internacionales, ni de los países que comparten este sistema de reparación laboral, OMS, OIT, USA, España, Chile, Alemania, etc..
El Síndrome Cervicobraquial es una alteración que habitualmente no se diagnostica en los consultorios de los médicos asistenciales sino que es patrimonio exclusivo de las demandas laborales en los tribunales judiciales de Córdoba – Argentina. Esta patología, es mucho más referenciada por abogados laboralistas que por médicos asistenciales.
Muchos profesionales de la salud, se estarán preguntando qué es el SCB, cuáles son los síntomas y signos que componen este síndrome?. Lo concreto, es que esta patología no está descrita como entidad nosológica en ningún tratado actual de medicina clínica, quirúrgica, ortopédica, etc. por lo tanto, sus características semiológicas, están libradas a la interpretación independiente del profesional actuante.
En relación a la historia de este término, podríamos decir que se empleó en un principio, como sinónimo de Síndrome del Escaleno anterior, fue descripto en 19351 o antes, por un medico llamado Naffzinger3 que consideró que el conocido “Syndrome Cervicobrachial”, (tal como se dice en inglés), era producido casi exclusivamente por una anexititis (inflamación del axón nervioso) por compresión del paquete vasculo nervioso del brazo, al atravesar entre el músculo Escaleno Anterior y Escaleno Medio, por alteraciones de estos músculos. El paquete vasculo-nervioso es como una cañería por donde transitan arterias, venas y nervios. Por esta razón se lo llamaba Síndrome del Escaleno Anterior (SEA), nombre que perduró a la actualidad, no así el de Cervicobraquial. Entre las personas que se describió esta patología, había algunos trabajadores de ferrocarril, habría que imaginarse cómo era la tarea de estos operarios al comienzo del siglo XX, Posteriormente un médico llamado Kenneth H. Aynesworth4, escribió un artículo donde mencionó que el SEA, descrito por Naffzinger, no era la única causa de Síndrome Cervicobraquial y realizó una larga lista de diagnósticos diferenciales, donde siempre formaba parte el compromiso del paquete vasculo-nervioso del brazo por compresión de los músculos escalenos o por fibrosis de la zona o por alteración congénita del recorrido del paquete vasculo-nervioso, por la presencia de costillas cervicales, etc..
Habría que dejar en claro, que esta patología no consiste exclusivamente en dolor del cuello y brazo, que presenta una serie de síntomas y signos neurológicos y circulatorios que generan secuelas grave si no se tratan a tiempo. Estas alteraciones concebidas a nivel del hombro, producían un déficit de irrigación sanguínea en el brazo, con isquemia primero y si el proceso se prolongaba terminaban en gangrena de territorio vascular, tal como lo muestran las foto extraídas del artículo de Donald1.
No quisiera parecer un diario sensacionalista mostrando imágenes no aptas para sensibles,
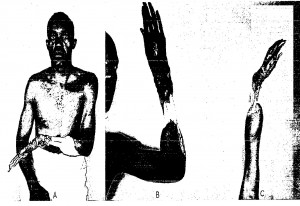
pero si dejar bien en claro que esta patología, librada a su suerte, dejaba lesiones de consideración a principio del siglo XX, cuando todavía no se la identificaba bien, por suerte ese tipo de lesiones ya no se observan.
Las lesiones que se observan en la foto, son producto de la gangrena que se generaba por las alteraciones circulatorias que acompañaban al Síndrome Cervico-braquial o Síndrome del Escaleno, la única solución terapéutica que se le podía ofrecer a estos pacientes, con semejante lesión, era la amputación del brazo. Actualmente los diagnósticos son precoces y dependerá de la etiología que lo genera, en el caso del SEA, la indicación terapéutica es quirúrgica, con Tenectomía del músculo escaleno.
Estos signos y síntomas no guardan relación con la sintomatología anodina que refieren los trabajadores que reclaman esta patología en la Justicia Laboral, los cuales solo manifiestan dolores erráticos que nunca los lleva a consultar a un medico asistencial.
A partir de la descripción de las distintas causas que ocasionaban el Síndrome Cervicobraquial, en la práctica médica, estas patologías se fueron identificando por sus nombres etiológicos y el término de Síndrome Cervicobraquial quedo relegado exclusivamente a cuando no se conocía la causa de los síntomas mencionados por el paciente. Hoy esa opción a quedado totalmente desfasada por la gran variedad y evolución que han tenido de los métodos complementarios del diagnóstico. En la actualidad, en la consulta médica diaria, el término Síndrome Cervicobraquial, no se usa y fue remplazado por los diagnósticos como: Síndrome del Escaleno Anterior, Síndrome de la costilla cervical, Síndrome de la salida torácica, etc. según su patogenia
Otra pregunta a contestarnos, es cómo esta entidad clínica desconocida y obsoleta, llegó a formar parte del listado del Enfermedades Profesionales, decreto 658/96, de la ley de Riesgo del trabajo en la Argentina?.
Como alguna vez mencioné, los asesores de la OPS, responsables de la elaboración de las listas de enfermedades profesionales, presentaron en un primer momento una lista bastante completa que debía ser aprobada por los representantes de sindicatos, empresarios y gobierno antes de decretarse y de estas negociaciones se introdujeron algunos cambios y nuevos aportes a las enfermedades presentadas, algunos de ellos positivos y otros desafortunados, pero casi todos entraron sin una evaluación científicas de las patologías aportadas por las distintas instituciones. Este hecho no hubiera tenido trascendencia, si hubiera sido acotado claramente, por el Laudo 405/96 del Ministerio de Trabajo y Seguridad Social, “Manual de Procedimiento para el Diagnóstico de Enfermedades Profesionales”, pero tampoco en este manual aparece explícitamente mencionado el SCB, lo cual permite la libre interpretación médico legal de la patología, hecho que no ocurre con otras enfermedades profesionales, las cuales son abordadas más detalladamente, como las generadas por agentes de riesgo biológicos, químicos o cánceres .
Todas esta cadena de desaciertos, llevaron a tener dentro del decreto 658/96, formando parte del listado de Enfermedades Profesionales de la República Argentina, una terminología anticuada que no está descrita como enfermedad en los tratados de medicina actual.
Esto no hubiera trascendido más allá de lo anecdotario, si la “viveza criolla”, el oportunismo, la especulación de abogados, médicos y trabajadores, sumados a la apatía judicial, no hubieran facilitado y promovido la industria del juicio con el enorme costo económico que le ha representado a las empresas con empleados.
De todas maneras no todo está perdido, no sería muy complicado ni costoso revertir esta situación, por un lado requeriría que un grupo de técnicos idóneos y honestos, con manejo bibliográfico y metodología científica, revisaran, ordenaran y protocolizaran el decreto 658/96 y el Laudo 405/96 de MTySS y los demás decretos que reglamentan esta ley en referencia al listado de Enfermedades Profesionales y por el otro, que la justicia exija a sus peritos técnicos de oficio la aptitud y capacitación necesaria para asesorar con criterios científicos a los jueces.
María E. Torres Mariano
Bibliografía
-
The ScalenusAnticus Syndrome With and Without Cervical Rib Donald, Joseph M. Morton, Benjamin F.Annal Surgery 1940 May;111(5):709–723
-
Ochsner, A., Gage, M., and DeBakey, M.: Scalenus Anticus (Naffziger) Syndrome Am. Jour. Surg., 28, 669, I935
-
Naffziger, H. C., and Grant, W. T.: Neuritis of the Brachial Plexus Mechanical in Origin; The Escaleno Syndrome. Surg., Gynec. and Obstet., 67, 722, I938.
-
Aynesworth Kenneth H. THE CERVICOBRACHIAL SYNDROME: A DISCUSSION OF THE ETIOLOGY WITH REPORT OF TWENTY CASES. Ann Surg. 1940 May;111(5):724–742)
-
Síndrome Cervicobraquial. Propuesta de actualización del Baremo Laboral argentino Rev Asoc Esp Espec Med Trab vol.33 no.2 Madrid jun. 2024 Epub 07-Oct-2024