¿Son peligrosas las manicuras en gel?

Artículo publicado en The New York Times el 22 de febrero de 2023
IDONEIDAD, HONESTIDAD, VOCACIÓN DE SERVICIO

Artículo publicado en The New York Times el 22 de febrero de 2023

La valoración del daño corporal es un procedimiento médico-legal que tiene como objetivo determinar, de forma objetiva y técnica, las consecuencias que una lesión, enfermedad o accidente ha generado en una persona. No solo se considera el daño físico visible, sino también el impacto funcional, psicológico y social que esa situación provoca.
Este tipo de evaluación es clave en contextos como:
Su finalidad es establecer si existe daño, qué tipo es, cuál es su gravedad y si es permanente o recuperable. También se analiza la relación de causalidad entre el hecho y el daño.
La valoración contempla distintas dimensiones del daño:
Cada tipo se analiza de forma técnica, con herramientas médicas, psicológicas y funcionales, respetando el encuadre legal que le corresponda.
La valoración del daño corporal debe ser realizada por un médico especializado en medicina legal o pericia médica, con experiencia en dictámenes objetivos y conocimiento de normativas legales y baremos vigentes (criterios que permiten cuantificar el daño).
Un informe bien elaborado suele contener:
El informe de valoración del daño corporal es una herramienta fundamental para la justicia, las aseguradoras, las ART y los abogados, ya que permite establecer compensaciones, indemnizaciones o decisiones judiciales con base objetiva.
También puede ser solicitado por los propios pacientes que desean conocer el alcance real de una lesión y sus implicancias legales.
La valoración del daño corporal es mucho más que describir una lesión. Es una evaluación compleja, interdisciplinaria y rigurosa que traduce el sufrimiento físico o psicológico en datos objetivos útiles para la toma de decisiones jurídicas, laborales o personales.

Ni presionar para que coman ni restringir la comida es una buena idea
Las mamás y los papás con sobrepeso a menudo limitan la ingesta de comida, pero los que tienen un peso normal presionan a los niños para que coman más
Una nueva investigación halla que los padres de niños con sobrepeso son más propensos a restringir la ingesta de comida de sus hijos (lo que potencialmente es una mala idea) si ellos mismos tienen un exceso de peso.
Por el contrario, las mamás y los papás son más propensos a presionar a sus hijos para que coman más si los padres y los niños tienen un peso normal.
Ni presionar para que coman ni restringir la comida es una buena idea, dijo la autora del estudio, Jerica Berge, profesora asociada de medicina de familia y salud comunitaria en la Facultad de Medicina de la Universidad de Minnesota, en Minneapolis.
«Las investigaciones anteriores han mostrado que podrían tener efectos indeseados, como por ejemplo que un niño llegue a tener sobrepeso u obesidad, o que realice conductas como darse atracones o de tipo purgativo», indicó. La obesidad infantil también se asocia con una serie de problemas para la salud, lo que incluye a la diabetes tipo 2 y las enfermedades cardiacas.
Los investigadores analizaron los resultados de dos estudios de 2010 sobre el consumo de alimentos de los niños. Más de 2,100 adolescentes, cuya edad promedio era de 14 años, participaron en los estudios junto con 3,252 padres (el 63 por ciento de ellos eran madres, con una edad promedio de 43 años).
«Cuando los padres y los adolescentes tenían sobrepeso u obesidad, los padres eran más propensos a restringir los alimentos que comían los hijos adolescentes», dijo Berge. «Cuando los padres y los adolescentes tenían todos un peso normal, los padres eran más propensos a presionar a sus hijos a que comieran más».
Berge dijo que los hallazgos pueden ayudar a los profesionales de la atención sanitaria a observar a los padres y a sus hijos juntos y averiguar quién, en función de su peso, podría tener el riesgo más alto de unos malos hábitos de alimentación.
Laura Hubbs-Tait, profesora de desarrollo humano y especialista en crianza en la Universidad Estatal de Oklahoma, en Stillwater, dijo que el estudio es válido y útil. Pero, indicó, no demuestra que los padres actúen de cierta manera (presionando a sus hijos para que coman o no) según el peso de los padres o de los niños. Hace falta más investigación para confirmarlo, sostuvo.
Sea lo que sea, los padres que presionan a sus hijos para que coman más o menos comida se arriesgan a criar a niños que no saben por sí mismos cuánto deben comer. «Muchos padres quizá no sean conscientes de que sus esfuerzos por controlar la alimentación de sus hijos perjudica la capacidad de sus hijos de regular por sí mismos lo que comen», dijo.
En lugar de presionar para que coman más o para que no coman tanto, ¿qué deberían hacer los padres?
«Es más útil que los padres se aseguren de que haya una variedad de opciones saludables en casa o en la mesa para que los niños coman, y entonces permitirles que decidan cuánto comen», dijo Berge. «También es importante seguir ofreciendo comida, porque puede que sea necesario que se exponga varias veces a un alimento antes de que un niño lo coma».
Los padres que estén preocupados sobre la ingesta alimentaria de su hijo deberían ir al médico, señaló.
Hubbs-Tait ofreció las siguientes sugerencias: «Los padres deberían ayudar a los niños a aprender cómo regular su propia alimentación, ayudándoles a tomar buenas decisiones con respecto a la buena comida y la actividad física, y aportar muchos ánimos y respaldo cuando lo hagan».
El estudio aparece en línea el 24 de agosto en la revista Pediatrics.

Un estudio reciente publicado en BMC Health Services Research titulado «The association between physician sex and patient outcomes: a systematic review and meta-analysis» ha arrojado luz sobre cómo el sexo del médico puede influir en los resultados clínicos de los pacientes. Esta investigación es pionera en cuantificar el efecto del sexo del médico en pacientes adultos que reciben atención médica o quirúrgica. Las mujeres médico, tiene una taza levemente inferior de mortalidad y complicaciones en sus pacientes que sus pares hombres.
Los investigadores llevaron a cabo una revisión sistemática y un meta-análisis de estudios observacionales que incluían a adultos (mayores de 18 años) y evaluaban el impacto del sexo del médico en diversas especialidades médicas y quirúrgicas. Se incluyeron 35 estudios, con un total de 13.404.840 pacientes. De estos, 20 estudios (8.915.504 pacientes) analizaron el efecto del sexo del cirujano, mientras que los 15 restantes (4.489.336 pacientes) se centraron en médicos de otras áreas, incluyendo anestesiología. La calidad de los estudios se evaluó utilizando la herramienta ROBINS-I, clasificando 15 estudios con riesgo moderado de sesgo, 15 con riesgo grave y 5 con riesgo crítico.
Uno de los hallazgos más destacados fue que la mortalidad general fue significativamente menor en pacientes atendidos por médicas en comparación con aquellos atendidos por médicos varones (OR 0,95; IC 95%: 0,93 a 0,97). Este resultado fue consistente tanto en especialidades quirúrgicas como no quirúrgicas. Además, no se detectó evidencia significativa de sesgo de publicación en este análisis.
En cuanto a las readmisiones hospitalarias, los pacientes que recibieron atención médica o anestésica por parte de médicas presentaron una tasa de readmisión ligeramente inferior (OR 0,97; IC 95%: 0,96 a 0,98). Sin embargo, es importante destacar que, aunque estas diferencias son estadísticamente significativas, la magnitud del efecto es modesta.
Los autores del estudio sugieren varias hipótesis para explicar estas diferencias en los resultados según el sexo del médico. Algunos estudios previos han indicado que las médicas pueden adherirse más estrictamente a las guías clínicas y ofrecer una comunicación más centrada en el paciente, lo que podría influir positivamente en los resultados clínicos. Además, se ha observado que las médicas tienden a proporcionar una mayor cantidad de consejería preventiva y adoptan un enfoque más holístico en la atención al paciente.
No obstante, es crucial considerar que la relación entre el sexo del médico y los resultados de los pacientes es compleja y puede estar influenciada por múltiples factores, como la carga de trabajo, las especialidades médicas y las dinámicas del equipo de atención médica. Además, la presencia de sesgos de género y estereotipos en el entorno clínico podría afectar tanto la percepción como la realidad de la atención brindada.
Este estudio destaca la importancia de reconocer y abordar las diferencias potenciales en la práctica clínica relacionadas con el sexo del médico. Si bien los hallazgos sugieren una ventaja asociada con la atención proporcionada por médicas, es esencial que todos los profesionales de la salud, independientemente de su sexo, se esfuercen por adherirse a las mejores prácticas basadas en evidencia y fomenten una comunicación efectiva y centrada en el paciente.
Además, estos resultados podrían tener implicaciones en la formación médica y en el desarrollo profesional continuo, enfatizando la necesidad de incorporar estrategias que promuevan una atención más empática y centrada en el paciente. También es fundamental que las instituciones de salud consideren estos hallazgos al diseñar políticas y programas que busquen mejorar la calidad de la atención y los resultados clínicos.
La investigación publicada en BMC Health Services Research proporciona evidencia valiosa sobre la asociación entre el sexo del médico y los resultados de los pacientes. Las mujeres médico tienen índices levemente inferiores de mortalidad, reinternaciones y complicaciones en sus pacientes. Aunque las diferencias observadas son modestas, resaltan la necesidad de continuar explorando cómo las características de los profesionales de la salud pueden influir en la calidad de la atención y en los resultados clínicos. Futuros estudios podrían profundizar en los mecanismos subyacentes a estas diferencias y cómo pueden ser aprovechados para mejorar la atención al paciente en todos los contextos clínicos.
El artículo completo en BMC Health Services Research

La enfermedad de Chagas, endémica en América Central y América del Sur. La consecuencia más importante de la infección por T. cruzi es la miocardiopatía. El tratamiento de primera línea es el benznidazol. Autor: Caryn Bern Chagas’ Disease New England Journal of Medicine 2015;373:456-66
La enfermedad de Chagas, endémica en América Central y América del sur, es causada por el parásito protozoario Trypanosoma cruzi, que se transmite cuando las heces infectadas del vector triatomino se inoculan a través del lugar de la picadura o de una membrana mucosa intacta del huésped. La consecuencia más importante de la infección por T. cruzi es la miocardiopatía. El tratamiento de primera línea es el benznidazol.
La enfermedad de Chagas es causada por el parásito protozoario Trypanosoma cruzi, que se transmite cuando las heces infectadas del vector Triatoma infestans (vinchuca) se inoculan a través del lugar de la picadura o de una membrana mucosa intacta del huésped mamífero. La transmisión a través del vector se limita a zonas de América del norte, América Central y América del sur.
Tanto en zonas endémicas como no endémicas, otras vías de infección son las transfusiones, los trasplantes de órganos y de médula ósea y la transmisión congénita. Se informó sobre brotes atribuidos a alimentos o bebidas contaminadas en la zona norte de América del sur, donde la transmisión es importante. La infección es de por vida, ya que no existe un tratamiento eficaz. La consecuencia más importante de la infección por T. Cruzi es la miocardiopatía, que se produce en el 20 – 30% de las personas infectadas.
Las características epidemiológicas de la enfermedad de Chagas son el resultado de dos fuerzas importantes: la transmisión doméstica del vector a lo largo de la vida de la población actual de América latina, la migración de zonas rurales a zonas urbanas en gran escala durante los últimos 50 años. Los vectores epidemiológicamente más importantes viven entre las grietas de las paredes de barro y los techos de paja de los ranchos rurales. Los habitantes de las viviendas infectadas están expuestos repetidamente al vector y el parásito durante muchos años. La transmisión a través de las heces de un vector infectado es relativamente ineficiente: la incidencia de infección por T. cruzi se estima que es menor del 1% por año. La mayor incidencia estimada es del 4% al año, en el Chaco boliviano, que es hiperendémico.
En un ámbito endémico, la transmisión continua produce un patrón de prevalencia creciente con la edad, tanto de la infección como de la miocardiopatía. Durante las últimas décadas, millones de personas infectadas se trasladaron de aldeas y caseríos rurales endémicos a ciudades latinoamericanas y cientos de miles viven en los EEUU, España y otros países. América latina efectuó considerables progresos hacia la eliminación de la enfermedad de Chagas. La prevalencia global estimada de infección por T. Cruzi disminuyó de 18 millones en 1991, cuando comenzó la primera iniciativa regional de control, a 5,7 millones en 2010.
La Organización Panamericana de la Salud (OPS) certificó la interrupción de la transmisión por vectores domésticos en varios países de América del sur y América Central. Se efectúa pesquisa serológica del T. cruzi en la mayoría de los bancos de sangre de los países endémicos y algunos efectúan pesquisa sistemática de la enfermedad de Chagas congénita. No obstante, la enfermedad de Chagas sigue siendo la parasitosis más importante del hemisferio occidental, con una carga de enfermedad 7,5 veces mayor que la del paludismo.
El período de incubación tras la transmisión por el vector es de 1 – 2 semanas. La característica patognomónica de la fase aguda es la parasitemia que se detecta microscópicamente.
Los síntomas suelen ser leves e inespecíficos: fiebre, malestar general, hepatoesplenomegalia y linfocitosis atípica. En raros casos, un nódulo cutáneo (chagoma) o el edema palpebral unilateral indoloro prolongado (signo de Romaña) indican el lugar de la inoculación. La gran mayoría de las infecciones agudas no se detectan. En menos del 1% de las infecciones, la fase aguda es grave y puede ser mortal debido a meningoencefalitis o miocarditis. Los brotes de infección pr T. cruzi transmitida por vía oral (por alimentos o bebidas contaminadas con heces del vector) parecen estar asociados con mayor incidencia de miocarditis y mayor tasa de letalidad que las infecciones transmitidas por el vector.
En los sobrevivientes de la fase aguda, la respuesta de inmunidad celular detiene la replicación del parásito, los síntomas se resuelven espontáneamente y la parasitemia desaparece en 4 – 8 semanas. Los infectados pasan a la fase crónica de la infección por T. cruzi. La mayoría permanecen asintomáticos, pero están infectados de por vida. Se estima que el 20 – 30% de las personas infectadas progresan con el curso de los años a miocardiopatía chagásica crónica. Los signos más tempranos son defectos del sistema de conducción, especialmente bloqueo de rama derecha o bloqueo de la rama anterior izquierda. Las contracciones ventriculares prematuras multiformes son otro signo temprano, pero pueden pasar desparecibidas si no se efectúa un monitoreo electrocardiográfico (ECG) ambulatorio.
La miocardiopatía chagásica es muy arritmógena y se caracteriza por bradicardias sinusales y de la unión, fibrilación o aleteo auricular, bloqueos auriculoventriculares y taquicardia ventricular no sostenida o sostenida. Los pacientes afectados con el tiempo progresan a miocardiopatía dilatada e insuficiencia cardíaca congestiva. Cuando la miocardiopatía es avanzada, los aneurismas del ventrículo izquierdo son frecuentes.
Los pacientes pueden sufrir accidentes cerebrovasculares u otros episodios tromboembólicos debido a la formación de trombos en el ventrículo izquierdo dilatado o con aneurisma. Las personas infectadas sin miocardiopatía manifiesta pueden tener alteraciones sutiles en el ecocardiograma, pero se desconoce el valor pronóstico de estos signos.
Si bien la patogénesis de la miocardiopatía chagásica no se conoce bien, hay consenso en que la persistencia del parásito es esencial para la enfermedad, lo cual confiere nueva urgencia a la búsqueda de un tratamiento antitripanosómico de gran eficacia durante la fase crónica. La evidencia sugiere que la respuesta inmunitaria inflamatoria del huésped es el determinante más importante de la progresión, con la virulencia de la cepa de T. cruzi y el tropismo tisular como posibles factores contribuyentes.
Para la supervivencia durante la fase aguda es necesaria una respuesta inflamatoria con participación de las células inmunitarias innatas y los macrofágos activados por el interferón-γ y el factor α de necrosis tumoral. En la fase crónica, la inmunidad mediada por las células T mantiene controlada la replicación parasitaria. Sin embargo, la incapacidad de disminuir la respuesta inflamatoria, mantenida por la persistencia del parásito e influida por factores del huésped y del parásito, parece ser predominante en la patogénesis.
Investigadores observaron que la prevalencia de miocardiopatía chagásica grave descendió en zonas con control eficaz del vector. Plantean que la sobreinfección repetida debida a exposición continua al vector mantiene la carga de antígeno tisular y la consiguiente respuesta inflamatoria a un nivel crónico más alto, que promueve el daño cardíaco.
La enfermedad de Chagas gastrointestinal afecta predominantemente el esófago, el colon o ambos y se produce por daño a las neuronas intramurales. Las manifestaciones de enfermedad esofágica comprenden desde trastornos asintomáticos de la motilidad y acalasia leve hasta megaesófago grave con disfagia, odinofagia, reflujo esofágico, adelgazamiento, aspiración, tos y regurgitación. El megacolon se caracteriza por estreñimiento prolongado y puede generar fecaloma, vólvulo e isquemia intestinal. La enfermedad de Chagas gastrointestinal es menos frecuente que la miocardiopatía chagásica y es más común en el Cono sur (Argentina, Bolivia, Chile, Paraguay, Uruguay y partes de Brasil) que en el resto de las zonas endémicas.
La infección aguda en pacientes receptores de órganos trasplantados tiene un período de incubación prolongada y un espectro clínico más grave, que puede incluir miocarditis aguda e insuficiencia cardíaca congestiva. La reactivación de la infección crónica por T. cruzi se produce principalmente en pacientes que recibieron un trasplante de órganos y en adultos con infección simultánea por VIH y T. cruzi. En ambas poblaciones, el riesgo de reactivación está en relación con la gravedad de la inmunosupresión.
En un estudio longitudinal con pacientes con infección simultánea por VIH, aproximadamente el 20% sufrieron reactivación, con más frecuencia meningoencefalitis, abscesos cerebrales o ambos. La segunda manifestación más frecuente es la miocarditis aguda, que a veces se superpone con la miocardiopatía prexistente. Manifestaciones menos frecuentes son lesiones de la piel e invasión parasitaria del peritoneo, el estómago o el intestino.
La supervivencia de pacientes sometidos a trasplante cardíaco por miocardiopatía chagásica terminal es igual o mayor que la de los trasplantados por miocardiopatía idiopática o isquémica. En pacientes trasplantados, la reactivación del T. cruzi es una causa rara de muerte. Se la debe considerar en el diagnóstico diferencial de episodios febriles y crisis de rechazo aparente. La afectación del sistema nervioso central es mucho menos frecuente entre los receptores de trasplante con reactivación que entre los pacientes con infección simultánea por VIH y T. cruzi.
En la fase aguda se pueden detectar tripomastigotes móviles por examen microscópico de sangre fresca anticoagulada o de capa leucocítica. Los parásitos también se pueden ver en extendidos de sangre teñidos con Giemsa y pueden crecer en un hemocultivo en un medio especializado. La reacción en cadena de la polimerasa (PCR, por las siglas en inglés) es una herramienta sensible en la fase aguda y es la mejor prueba para la detección temprana de la infección en el receptor del órgano trasplantado de un donante infectado o tras una exposición accidental.
La enfermedad de Chagas congénita es una infección aguda y se emplean los mismos métodos diagnósticos. Para los lactantes en riesgo, en quienes la enfermedad de Chagas no se diagnosticó al nacer, se recomiendan las pruebas serológicas tradicionales después de los 9 meses, cuando los anticuerpos maternos ya desaparecieron.
El diagnóstico de infección crónica se basa sobre las pruebas serológicas IgG, en general mediante ensayo inmunoenzimático (ELISA) o la prueba de anticuerpos inmunofluorescentes. Ninguna prueba para la infección crónica por T. cruzi tiene suficiente sensibilidad y especificidad para ser empleada sola; son necesarios los resultados positivos de dos pruebas, preferentemente basadas sobre diferentes antígenos (por ejemplo, lisado de parásito y antígenos recombinantes), para su confirmación.
La PCR para el T. cruzi se emplea cada vez más como herramienta de investigación y de control. Su sensibilidad en la fase crónica de la enfermedad de Chagas es sumamente variable y depende del volumen y el procesamiento de la muestra, las características de la población y los primers y métodos para la PCR. Los resultados negativos de la PCR no significan que no haya infección.
El control sistemático por medio de la PCR de muestras seriadas de sangre es necesario para el reconocimiento temprano de la infección aguda por T. cruzi derivada de órganos; el tratamiento oportuno puede salvar la vida. Las pruebas cuantitativas de PCR pueden ser útiles para controlar la reactivación (por ejemplo, tras el trasplante cardíaco); la PCR positiva no significa que haya habido reactivación, pero una carga parasitaria que aumenta con el tiempo es el indicador más precoz y más sensible.
El nifurtimox y el benznidazol son los únicos fármacos de probada eficacia para la infección por T. cruzi.
El benznidazol, derivado del nitroimidazol, se considera como el tratamiento de primera línea, por tener menos efectos tóxicos y mayor evidencia de eficacia que el nifurtimox. Los efectos adversos más frecuentes son dermatológicos- erupciones leves que responden a los antihistamínicos. La dermatitis intensa o exfoliativa o la dermatitis asociada con fiebre y adenopatías son causa de interrupción inmediata del tratamiento.
Una neuropatía periférica dependiente de la dosis a veces aparece tardíamente durante el tratamiento y exige la interrupción inmediata del mismo; casi siempre es reversible, pero puede durar meses. La depresión medular es rara y exige la supresión inmediata del tratamiento.
El nifurtimox, un nitrofurano, inhibe la síntesis de ácido pirúvico y altera el metabolismo de los hidratos de carbono del T. cruzi. Se producen efectos secundarios gastrointestinales (anorexia, adelgazamiento, náuseas y vómitos) en hasta el 70% de los pacientes. Los efectos tóxicos neurológicos son irritabilidad, insomnio, desorientación y temblores. Efectos secundarios raros, pero más graves, son parestesias, polineuropatía y neuritis periférica. Los efectos tóxicos tanto del nifurtimox como del benznidazol son menores en niños pequeños que en adolescentes o adultos.
Un estudio farmacocinésico reciente mostró quela eliminación del benznidazol en los grupos etarios más jóvenes es significativamente más rápida que en pacientes mayores, por lo que la concentración del fármaco es menor en más jóvenes. Esto plantea la posibilidad de que dosis más bajas de benznidazol en adultos podrían ser eficaces al mismo tiempo que disminuir los efectos colaterales graves.
En pacientes con enfermedad de Chagas aguda y en aquellos con Chagas congénito, el benznidazole y el nifurtimox disminuyen la intensidad de los síntomas, acortan el curso de la enfermedad y reducen la duración de la parasitemia; la tasa de curación en la fase aguda se estima en el 80 – 90%.
Hasta la década de 1990, se creía que solo la fase aguda de la infección respondía al tratamiento. Sin embargo, dos estudios controlados con placebo de benznidazol en niños con infección crónica por T. cruzi mostraron tasas de curación de aproximadamente el 60%, con pruebas serológicas negativas 3 – 4 años después del tratamiento. Estudios de seguimiento sugirieron que cuanto más pequeños sean los niños que reciben tratamiento, mayor será la tasa de conversión de positivo a negativo de las pruebas serológicas (seroconversión negativa). Junto con la creciente experiencia en América latina, estos estudios motivaron un gran cambio en el tratamiento de la infección en niños, transformando el diagnóstico precoz y el tratamiento antitripanosómico en la norma asistencial en toda la región.
Durante los últimos 15 años se produjo un movimiento creciente para extender el tratamiento a los adultos con infección crónica, entre ellos aquellos con miocardiopatía incipiente. Casi todos los especialistas opinan que se debe ofrecer tratamiento a la mayoría de los pacientes con infección crónica por T. cruzi, con criterios de exclusión, como un límite superior de edad de 50 – 55 años y la presencia de miocardiopatía avanzada irreversible.
Este cambio en las normas asistenciales se basa en parte sobre estudios longitudinales no ciegos, no aleatorizados, que mostraron disminución significativa de la progresión de la miocardiopatía y tendencia a menor mortalidad entre adultos tratados con benznidazol, en relación con pacientes no tratados. En este año se terminará el estudio Benznidazole Evaluation for Interrupting Trypanosomiasis (BENEFIT), un gran estudio multicéntrico, doble ciego, aleatorizado, controlado con placebo, de benznidazol para el tratamiento de pacientes con miocardiopatía chagásica. Estudios de observación también confirmaron que mujeres tratadas antes del embarazo tienen significativamente menos probabilidades que mujeres no tratadas de transmitir la infección a sus hijos.
Los marcadores serológicos tradicionales responden muy lentamente después del tratamiento; el tiempo hasta la seroconversión negativa se mide en años y hasta en décadas y es inversamente proporcional a la duración de la infección antes del tratamiento. En estudios clínicos aleatorizados recientes de dos azoles relacionados para el tratamiento de adultos infectados con T. cruzi se emplearon los resultados de la PCR cuantitativa como criterio principal de valoración.
En un estudio con posaconazol, los criterios de incorporación al estudio fueron los resultados positivos de la PCR previos al tratamiento. La parasitemia se eliminó al término del tratamiento con posaconazol, pero volvió a tener niveles detectables en el 80% – 90% de los pacientes 12 meses después. En cambio, sólo el 6% de los pacientes que completaron el tratamiento de 60 días con benznidazol tuvieron resultados positivos de PCR en algún momento posterior al tratamiento. Se informaron resultados similares de un estudio con el profármaco ravuconazol E1224, en el que la frecuencia de PCR positiva a los 12 meses fue considerablemente mayor entre pacientes que recibieron el ravuconazol que entre pacientes que recibieron el benznidazol. Estos resultados, apoyan el empleo de la PCR cuantitativa como parámetro de resultados en estudios clínicos: aunque los resultados negativos no son prueba de curación, los resultados positivos proporcionan evidencia oportuna e inequívoca de fracaso del tratamiento.
Se recomiendan evaluaciones cardíacas anuales, entre ellas el ECG de 12 derivaciones, para todas las personas con infección por T. cruzi, hayan o no completado el tratamiento antitripanosómico. Los síntomas cardíacos o las alteraciones del ECG indican la necesidad de un estudio cardíaco más profundo, con ecocardiograma, monitoreo ambulatorio del ECG y estudios electrofisiológicos. La disfunción del nódulo sinusal y los bloqueos aurículoventriculares de alto grado son frecuentes en la miocardiopatía chagásica y pueden ser indicación para la colocación de un marcapasos.
La mayoría de los cardiólogos con experiencia en enfermedad de Chagas prefieren amiodarona como fármaco de primera línea para las arritmias ventriculares y apoyan a los desfibriladores cardioversores implantables como otro método terapéutico en estos pacientes. La insuficiencia cardíaca congestiva se trata según las recomendaciones estándar. Debido a que las bradiarritmias son frecuentes en la miocardiopatía de la enfermedad de Chagas, es necesario el monitoreo cuidadoso cuando se emplean digoxina o betabloqueantes.
El trasplante cardíaco es un método eficaz para la miocardiopatía chagásica con insuficiencia cardíaca resistente al tratamiento. El control sistemático de la PCR postrasplante permite el diagnóstico y el tratamiento precoces de la reactivación del T. cruzi.
El tratamiento de la enfermedad de Chagas gastrointestinal es similar al de la acalasia idiopática o el megacolon. Los síntomas esofágicos se pueden aliviar con fármacos que relajen el esfínter o por miotomía laparoscópica. Las etapas tempranas de la alteración colónica pueden responder a dietas ricas en fibras y laxantes o enemas. Las etapas tardías del megaesófago y el megacolon quizás necesiten cirugía. El tratamiento antitripanosómico no influye sobre la progresión de la enfermedad de Chagas gastrointestinal.
La enfermedad de Chagas sigue siendo una causa importante de enfermedad y muerte prematura. Son necesarios mejores tratamientos y estudios rigurosos sobre fármacos para tratar la infección crónica por T. cruzi en los millones de personas que la padecen. Como progreso en los últimos años, se publicaron dos estudios aleatorizados, doble ciego, de nuevos fármacos, y validaron el empleo de métodos moleculares como indicadores oportunos de fracaso terapéutico; la búsqueda de una verdadera prueba de la curación continúa.
A pesar de los progresos en el control de la infección por el vector doméstico desde 1991, quedan algunos desafíos difíciles. Son necesarias nuevas estrategias para las zonas más endémicas, especialmente el Gran Chaco, donde es común la rápida reinfección doméstica y es cada vez más evidente la resistencia a los insecticidas. En zonas con amplia infección selvática, como la cuenca del Amazonas, la eliminación de los vectores es imposible. Es necesario implementar y mantener nuevos métodos para prevenir la transmisión por el vector y por vía oral.
*Traducción y resumen objetivo: Dr. Ricardo Ferreira
En nuestro país (Argentina) se estima que 1.500.000 personas, es decir el 4% de la población, padecen enfermedad de Chagas, cifras que significan un problema de salud pública. La OPS estima que 7-10 millones de personas la padecen en toda América latina.
El insecto vector es el que popularmente se llama “vinchuca”.
Aún no se han demostrado casos de transmisión oral en Argentina.
La producción de benznidazol había sido suspendida por el único laboratorio (multinacional) que lo fabricaba, debido a su falta de rentabilidad, quedando Brasil como productor mundial exclusivo. Tras meses de falta de stock, en 2012 se inició la producción en nuestro país a través del Ministerio de Salud en alianza con un laboratorio privado y una ONG. Actualmente, todos los países de América pueden acceder al principal tratamiento para la enfermedad de Chagas a través del fondo estratégico de la OPS.
*Todos los países de América ya pueden acceder al benznidazol, el medicamento para el tratamiento Chagas, a través de la Organización Panamericana de la Salud.

El teletrabajo o home office ha dejado de ser una medida temporal y se ha convertido en una modalidad laboral habitual en muchos sectores. Si bien aporta ventajas notables —como la flexibilidad horaria o la reducción de traslados— también plantea riesgos laborales específicos que no pueden ignorarse. A continuación, exploramos los más relevantes desde una perspectiva profesional y legal.
El entorno doméstico rara vez está diseñado para trabajar ocho horas frente a una computadora. Sillas sin soporte lumbar, pantallas mal ubicadas o mesas de cocina convertidas en escritorios improvisados pueden provocar:
¿Qué hacer?: Invertir en mobiliario ergonómico, realizar pausas activas y adaptar el espacio con supervisión de salud ocupacional.
El aislamiento social, la hiperconectividad y la dificultad para desconectar afectan la salud mental. Algunos efectos frecuentes son:
Recomendación: Definir horarios laborales claros, establecer límites digitales y fomentar espacios virtuales de interacción con el equipo.
El teletrabajo depende casi por completo de plataformas digitales. Esto implica:
Solución: Formación en ciberseguridad, protección de datos, y uso de software legal y actualizado.
Aunque trabajar en casa parece cómodo, también presenta dificultades como:
Clave: Crear un espacio de trabajo delimitado, con condiciones mínimas de confort, y comunicar límites a las personas del entorno doméstico.
Muchas organizaciones aún no han definido protocolos claros para el teletrabajo, lo que genera vacíos legales:
Aspecto legal fundamental: El trabajo remoto debe regularse mediante acuerdos escritos que incluyan condiciones laborales, derecho a la desconexión y evaluación de riesgos, conforme a la legislación vigente en cada país.
El home office exige un enfoque profesional, preventivo y legal. No se trata solo de conectar desde casa, sino de garantizar condiciones de trabajo dignas, seguras y productivas para todos.
¿Y en tu empresa? ¿Ya cuentas con una política clara de teletrabajo? ¿Se están evaluando los riesgos ergonómicos y psicosociales de tu equipo?
Es momento de revisar, actualizar y actuar. Porque el bienestar laboral también se construye a distancia.
No dejes el teletrabajo al azar.
Evaluá los riesgos, actualizá tus políticas y asegurá condiciones dignas para tu equipo, estés donde estés.
Actuá hoy. El bienestar laboral también se protege desde casa.
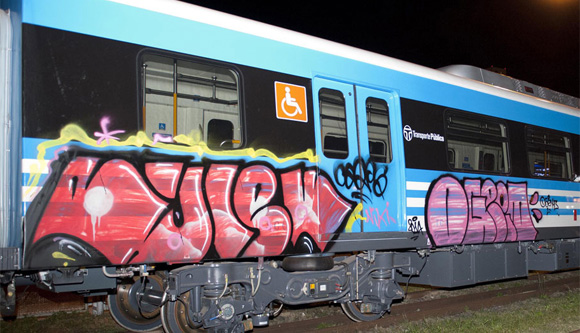
Ayer me sorprendió la noticia de que un grupo de adolescentes había realizado pintadas en los trenes recién adquiridos y aún no inaugurados del Ferrocarril Sarmiento. Las imágenes de los vagones vandalizados, sumadas a la indiferencia y soberbia con la que algunos de estos jóvenes se mostraban, generaron una mezcla de tristeza e impotencia. No solo se trata de un daño material: es una falta de respeto a toda la sociedad, una herida directa a los esfuerzos colectivos por construir un país mejor.
La reacción del entonces ministro del Interior y Transporte, Florencio Randazzo, fue contundente y cargada de enojo. Mientras algunos medios se enfocaban en polemizar sobre si sus declaraciones fueron exageradas o desafortunadas, lo cierto es que la discusión de fondo trasciende las formas: ¿qué hacemos como sociedad frente a estas conductas?
No basta con indignarnos ni con exigir que los padres paguen los daños —aunque la responsabilidad civil solidaria exista y sea justa en estos casos—. La verdadera pregunta es: ¿cómo educamos a estos chicos para que se conviertan en ciudadanos comprometidos, respetuosos y útiles para una Argentina que necesita de todos?
La sanción económica puede ser reparadora, pero no transforma. Por eso me pregunto: ¿por qué no implementar medidas restaurativas como el trabajo comunitario? Que limpien grafitis, pinten bancos de plazas, colaboren en escuelas públicas, ayuden a mejorar espacios comunes. No se trata de castigar, sino de reeducar y concientizar. De mostrarles que sus actos tienen consecuencias, pero también que pueden enmendarse y aprender.
La educación no es solo tarea de la escuela ni de la familia. Es una responsabilidad social compartida. Si queremos una Argentina más justa, segura y respetuosa, debemos involucrarnos todos. No para gritar ni señalar, sino para construir, enseñar, orientar.
Educar también es prevenir. Y prevenir es proteger el futuro.
Maria Torres Mariano