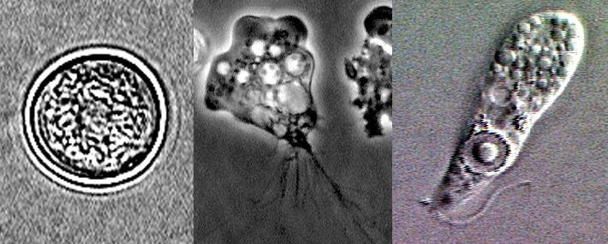
La enfermedad de Chagas, endémica en América Central y América del Sur. La consecuencia más importante de la infección por T. cruzi es la miocardiopatía. El tratamiento de primera línea es el benznidazol. Autor: Caryn Bern Chagas’ Disease New England Journal of Medicine 2015;373:456-66
Resumen
La enfermedad de Chagas, endémica en América Central y América del sur, es causada por el parásito protozoario Trypanosoma cruzi, que se transmite cuando las heces infectadas del vector triatomino se inoculan a través del lugar de la picadura o de una membrana mucosa intacta del huésped. La consecuencia más importante de la infección por T. cruzi es la miocardiopatía. El tratamiento de primera línea es el benznidazol.
La enfermedad de Chagas es causada por el parásito protozoario Trypanosoma cruzi, que se transmite cuando las heces infectadas del vector Triatoma infestans (vinchuca) se inoculan a través del lugar de la picadura o de una membrana mucosa intacta del huésped mamífero. La transmisión a través del vector se limita a zonas de América del norte, América Central y América del sur.
Tanto en zonas endémicas como no endémicas, otras vías de infección son las transfusiones, los trasplantes de órganos y de médula ósea y la transmisión congénita. Se informó sobre brotes atribuidos a alimentos o bebidas contaminadas en la zona norte de América del sur, donde la transmisión es importante. La infección es de por vida, ya que no existe un tratamiento eficaz. La consecuencia más importante de la infección por T. Cruzi es la miocardiopatía, que se produce en el 20 – 30% de las personas infectadas.
Epidemiología
Las características epidemiológicas de la enfermedad de Chagas son el resultado de dos fuerzas importantes: la transmisión doméstica del vector a lo largo de la vida de la población actual de América latina, la migración de zonas rurales a zonas urbanas en gran escala durante los últimos 50 años. Los vectores epidemiológicamente más importantes viven entre las grietas de las paredes de barro y los techos de paja de los ranchos rurales. Los habitantes de las viviendas infectadas están expuestos repetidamente al vector y el parásito durante muchos años. La transmisión a través de las heces de un vector infectado es relativamente ineficiente: la incidencia de infección por T. cruzi se estima que es menor del 1% por año. La mayor incidencia estimada es del 4% al año, en el Chaco boliviano, que es hiperendémico.
En un ámbito endémico, la transmisión continua produce un patrón de prevalencia creciente con la edad, tanto de la infección como de la miocardiopatía. Durante las últimas décadas, millones de personas infectadas se trasladaron de aldeas y caseríos rurales endémicos a ciudades latinoamericanas y cientos de miles viven en los EEUU, España y otros países. América latina efectuó considerables progresos hacia la eliminación de la enfermedad de Chagas. La prevalencia global estimada de infección por T. Cruzi disminuyó de 18 millones en 1991, cuando comenzó la primera iniciativa regional de control, a 5,7 millones en 2010.
La Organización Panamericana de la Salud (OPS) certificó la interrupción de la transmisión por vectores domésticos en varios países de América del sur y América Central. Se efectúa pesquisa serológica del T. cruzi en la mayoría de los bancos de sangre de los países endémicos y algunos efectúan pesquisa sistemática de la enfermedad de Chagas congénita. No obstante, la enfermedad de Chagas sigue siendo la parasitosis más importante del hemisferio occidental, con una carga de enfermedad 7,5 veces mayor que la del paludismo.
Características clínicas y patogénesis
El período de incubación tras la transmisión por el vector es de 1 – 2 semanas. La característica patognomónica de la fase aguda es la parasitemia que se detecta microscópicamente.
Los síntomas suelen ser leves e inespecíficos: fiebre, malestar general, hepatoesplenomegalia y linfocitosis atípica. En raros casos, un nódulo cutáneo (chagoma) o el edema palpebral unilateral indoloro prolongado (signo de Romaña) indican el lugar de la inoculación. La gran mayoría de las infecciones agudas no se detectan. En menos del 1% de las infecciones, la fase aguda es grave y puede ser mortal debido a meningoencefalitis o miocarditis. Los brotes de infección pr T. cruzi transmitida por vía oral (por alimentos o bebidas contaminadas con heces del vector) parecen estar asociados con mayor incidencia de miocarditis y mayor tasa de letalidad que las infecciones transmitidas por el vector.
En los sobrevivientes de la fase aguda, la respuesta de inmunidad celular detiene la replicación del parásito, los síntomas se resuelven espontáneamente y la parasitemia desaparece en 4 – 8 semanas. Los infectados pasan a la fase crónica de la infección por T. cruzi. La mayoría permanecen asintomáticos, pero están infectados de por vida. Se estima que el 20 – 30% de las personas infectadas progresan con el curso de los años a miocardiopatía chagásica crónica. Los signos más tempranos son defectos del sistema de conducción, especialmente bloqueo de rama derecha o bloqueo de la rama anterior izquierda. Las contracciones ventriculares prematuras multiformes son otro signo temprano, pero pueden pasar desparecibidas si no se efectúa un monitoreo electrocardiográfico (ECG) ambulatorio.
La miocardiopatía chagásica es muy arritmógena y se caracteriza por bradicardias sinusales y de la unión, fibrilación o aleteo auricular, bloqueos auriculoventriculares y taquicardia ventricular no sostenida o sostenida. Los pacientes afectados con el tiempo progresan a miocardiopatía dilatada e insuficiencia cardíaca congestiva. Cuando la miocardiopatía es avanzada, los aneurismas del ventrículo izquierdo son frecuentes.
Los pacientes pueden sufrir accidentes cerebrovasculares u otros episodios tromboembólicos debido a la formación de trombos en el ventrículo izquierdo dilatado o con aneurisma. Las personas infectadas sin miocardiopatía manifiesta pueden tener alteraciones sutiles en el ecocardiograma, pero se desconoce el valor pronóstico de estos signos.
Si bien la patogénesis de la miocardiopatía chagásica no se conoce bien, hay consenso en que la persistencia del parásito es esencial para la enfermedad, lo cual confiere nueva urgencia a la búsqueda de un tratamiento antitripanosómico de gran eficacia durante la fase crónica. La evidencia sugiere que la respuesta inmunitaria inflamatoria del huésped es el determinante más importante de la progresión, con la virulencia de la cepa de T. cruzi y el tropismo tisular como posibles factores contribuyentes.
Para la supervivencia durante la fase aguda es necesaria una respuesta inflamatoria con participación de las células inmunitarias innatas y los macrofágos activados por el interferón-γ y el factor α de necrosis tumoral. En la fase crónica, la inmunidad mediada por las células T mantiene controlada la replicación parasitaria. Sin embargo, la incapacidad de disminuir la respuesta inflamatoria, mantenida por la persistencia del parásito e influida por factores del huésped y del parásito, parece ser predominante en la patogénesis.
Investigadores observaron que la prevalencia de miocardiopatía chagásica grave descendió en zonas con control eficaz del vector. Plantean que la sobreinfección repetida debida a exposición continua al vector mantiene la carga de antígeno tisular y la consiguiente respuesta inflamatoria a un nivel crónico más alto, que promueve el daño cardíaco.
La enfermedad de Chagas gastrointestinal afecta predominantemente el esófago, el colon o ambos y se produce por daño a las neuronas intramurales. Las manifestaciones de enfermedad esofágica comprenden desde trastornos asintomáticos de la motilidad y acalasia leve hasta megaesófago grave con disfagia, odinofagia, reflujo esofágico, adelgazamiento, aspiración, tos y regurgitación. El megacolon se caracteriza por estreñimiento prolongado y puede generar fecaloma, vólvulo e isquemia intestinal. La enfermedad de Chagas gastrointestinal es menos frecuente que la miocardiopatía chagásica y es más común en el Cono sur (Argentina, Bolivia, Chile, Paraguay, Uruguay y partes de Brasil) que en el resto de las zonas endémicas.
Tripanosoma Cruzi en el huésped inmunocomprometido
La infección aguda en pacientes receptores de órganos trasplantados tiene un período de incubación prolongada y un espectro clínico más grave, que puede incluir miocarditis aguda e insuficiencia cardíaca congestiva. La reactivación de la infección crónica por T. cruzi se produce principalmente en pacientes que recibieron un trasplante de órganos y en adultos con infección simultánea por VIH y T. cruzi. En ambas poblaciones, el riesgo de reactivación está en relación con la gravedad de la inmunosupresión.
En un estudio longitudinal con pacientes con infección simultánea por VIH, aproximadamente el 20% sufrieron reactivación, con más frecuencia meningoencefalitis, abscesos cerebrales o ambos. La segunda manifestación más frecuente es la miocarditis aguda, que a veces se superpone con la miocardiopatía prexistente. Manifestaciones menos frecuentes son lesiones de la piel e invasión parasitaria del peritoneo, el estómago o el intestino.
La supervivencia de pacientes sometidos a trasplante cardíaco por miocardiopatía chagásica terminal es igual o mayor que la de los trasplantados por miocardiopatía idiopática o isquémica. En pacientes trasplantados, la reactivación del T. cruzi es una causa rara de muerte. Se la debe considerar en el diagnóstico diferencial de episodios febriles y crisis de rechazo aparente. La afectación del sistema nervioso central es mucho menos frecuente entre los receptores de trasplante con reactivación que entre los pacientes con infección simultánea por VIH y T. cruzi.
Diagnóstico de laboratorio
En la fase aguda se pueden detectar tripomastigotes móviles por examen microscópico de sangre fresca anticoagulada o de capa leucocítica. Los parásitos también se pueden ver en extendidos de sangre teñidos con Giemsa y pueden crecer en un hemocultivo en un medio especializado. La reacción en cadena de la polimerasa (PCR, por las siglas en inglés) es una herramienta sensible en la fase aguda y es la mejor prueba para la detección temprana de la infección en el receptor del órgano trasplantado de un donante infectado o tras una exposición accidental.
La enfermedad de Chagas congénita es una infección aguda y se emplean los mismos métodos diagnósticos. Para los lactantes en riesgo, en quienes la enfermedad de Chagas no se diagnosticó al nacer, se recomiendan las pruebas serológicas tradicionales después de los 9 meses, cuando los anticuerpos maternos ya desaparecieron.
El diagnóstico de infección crónica se basa sobre las pruebas serológicas IgG, en general mediante ensayo inmunoenzimático (ELISA) o la prueba de anticuerpos inmunofluorescentes. Ninguna prueba para la infección crónica por T. cruzi tiene suficiente sensibilidad y especificidad para ser empleada sola; son necesarios los resultados positivos de dos pruebas, preferentemente basadas sobre diferentes antígenos (por ejemplo, lisado de parásito y antígenos recombinantes), para su confirmación.
La PCR para el T. cruzi se emplea cada vez más como herramienta de investigación y de control. Su sensibilidad en la fase crónica de la enfermedad de Chagas es sumamente variable y depende del volumen y el procesamiento de la muestra, las características de la población y los primers y métodos para la PCR. Los resultados negativos de la PCR no significan que no haya infección.
El control sistemático por medio de la PCR de muestras seriadas de sangre es necesario para el reconocimiento temprano de la infección aguda por T. cruzi derivada de órganos; el tratamiento oportuno puede salvar la vida. Las pruebas cuantitativas de PCR pueden ser útiles para controlar la reactivación (por ejemplo, tras el trasplante cardíaco); la PCR positiva no significa que haya habido reactivación, pero una carga parasitaria que aumenta con el tiempo es el indicador más precoz y más sensible.
Tratamiento antitripanosómico
El nifurtimox y el benznidazol son los únicos fármacos de probada eficacia para la infección por T. cruzi.
El benznidazol, derivado del nitroimidazol, se considera como el tratamiento de primera línea, por tener menos efectos tóxicos y mayor evidencia de eficacia que el nifurtimox. Los efectos adversos más frecuentes son dermatológicos- erupciones leves que responden a los antihistamínicos. La dermatitis intensa o exfoliativa o la dermatitis asociada con fiebre y adenopatías son causa de interrupción inmediata del tratamiento.
Una neuropatía periférica dependiente de la dosis a veces aparece tardíamente durante el tratamiento y exige la interrupción inmediata del mismo; casi siempre es reversible, pero puede durar meses. La depresión medular es rara y exige la supresión inmediata del tratamiento.
El nifurtimox, un nitrofurano, inhibe la síntesis de ácido pirúvico y altera el metabolismo de los hidratos de carbono del T. cruzi. Se producen efectos secundarios gastrointestinales (anorexia, adelgazamiento, náuseas y vómitos) en hasta el 70% de los pacientes. Los efectos tóxicos neurológicos son irritabilidad, insomnio, desorientación y temblores. Efectos secundarios raros, pero más graves, son parestesias, polineuropatía y neuritis periférica. Los efectos tóxicos tanto del nifurtimox como del benznidazol son menores en niños pequeños que en adolescentes o adultos.
Un estudio farmacocinésico reciente mostró quela eliminación del benznidazol en los grupos etarios más jóvenes es significativamente más rápida que en pacientes mayores, por lo que la concentración del fármaco es menor en más jóvenes. Esto plantea la posibilidad de que dosis más bajas de benznidazol en adultos podrían ser eficaces al mismo tiempo que disminuir los efectos colaterales graves.
En pacientes con enfermedad de Chagas aguda y en aquellos con Chagas congénito, el benznidazole y el nifurtimox disminuyen la intensidad de los síntomas, acortan el curso de la enfermedad y reducen la duración de la parasitemia; la tasa de curación en la fase aguda se estima en el 80 – 90%.
Hasta la década de 1990, se creía que solo la fase aguda de la infección respondía al tratamiento. Sin embargo, dos estudios controlados con placebo de benznidazol en niños con infección crónica por T. cruzi mostraron tasas de curación de aproximadamente el 60%, con pruebas serológicas negativas 3 – 4 años después del tratamiento. Estudios de seguimiento sugirieron que cuanto más pequeños sean los niños que reciben tratamiento, mayor será la tasa de conversión de positivo a negativo de las pruebas serológicas (seroconversión negativa). Junto con la creciente experiencia en América latina, estos estudios motivaron un gran cambio en el tratamiento de la infección en niños, transformando el diagnóstico precoz y el tratamiento antitripanosómico en la norma asistencial en toda la región.
Durante los últimos 15 años se produjo un movimiento creciente para extender el tratamiento a los adultos con infección crónica, entre ellos aquellos con miocardiopatía incipiente. Casi todos los especialistas opinan que se debe ofrecer tratamiento a la mayoría de los pacientes con infección crónica por T. cruzi, con criterios de exclusión, como un límite superior de edad de 50 – 55 años y la presencia de miocardiopatía avanzada irreversible.
Este cambio en las normas asistenciales se basa en parte sobre estudios longitudinales no ciegos, no aleatorizados, que mostraron disminución significativa de la progresión de la miocardiopatía y tendencia a menor mortalidad entre adultos tratados con benznidazol, en relación con pacientes no tratados. En este año se terminará el estudio Benznidazole Evaluation for Interrupting Trypanosomiasis (BENEFIT), un gran estudio multicéntrico, doble ciego, aleatorizado, controlado con placebo, de benznidazol para el tratamiento de pacientes con miocardiopatía chagásica. Estudios de observación también confirmaron que mujeres tratadas antes del embarazo tienen significativamente menos probabilidades que mujeres no tratadas de transmitir la infección a sus hijos.
Los marcadores serológicos tradicionales responden muy lentamente después del tratamiento; el tiempo hasta la seroconversión negativa se mide en años y hasta en décadas y es inversamente proporcional a la duración de la infección antes del tratamiento. En estudios clínicos aleatorizados recientes de dos azoles relacionados para el tratamiento de adultos infectados con T. cruzi se emplearon los resultados de la PCR cuantitativa como criterio principal de valoración.
En un estudio con posaconazol, los criterios de incorporación al estudio fueron los resultados positivos de la PCR previos al tratamiento. La parasitemia se eliminó al término del tratamiento con posaconazol, pero volvió a tener niveles detectables en el 80% – 90% de los pacientes 12 meses después. En cambio, sólo el 6% de los pacientes que completaron el tratamiento de 60 días con benznidazol tuvieron resultados positivos de PCR en algún momento posterior al tratamiento. Se informaron resultados similares de un estudio con el profármaco ravuconazol E1224, en el que la frecuencia de PCR positiva a los 12 meses fue considerablemente mayor entre pacientes que recibieron el ravuconazol que entre pacientes que recibieron el benznidazol. Estos resultados, apoyan el empleo de la PCR cuantitativa como parámetro de resultados en estudios clínicos: aunque los resultados negativos no son prueba de curación, los resultados positivos proporcionan evidencia oportuna e inequívoca de fracaso del tratamiento.
Tratamiento de las secuelas crónicas de la infección por T. cruzi
Se recomiendan evaluaciones cardíacas anuales, entre ellas el ECG de 12 derivaciones, para todas las personas con infección por T. cruzi, hayan o no completado el tratamiento antitripanosómico. Los síntomas cardíacos o las alteraciones del ECG indican la necesidad de un estudio cardíaco más profundo, con ecocardiograma, monitoreo ambulatorio del ECG y estudios electrofisiológicos. La disfunción del nódulo sinusal y los bloqueos aurículoventriculares de alto grado son frecuentes en la miocardiopatía chagásica y pueden ser indicación para la colocación de un marcapasos.
La mayoría de los cardiólogos con experiencia en enfermedad de Chagas prefieren amiodarona como fármaco de primera línea para las arritmias ventriculares y apoyan a los desfibriladores cardioversores implantables como otro método terapéutico en estos pacientes. La insuficiencia cardíaca congestiva se trata según las recomendaciones estándar. Debido a que las bradiarritmias son frecuentes en la miocardiopatía de la enfermedad de Chagas, es necesario el monitoreo cuidadoso cuando se emplean digoxina o betabloqueantes.
El trasplante cardíaco es un método eficaz para la miocardiopatía chagásica con insuficiencia cardíaca resistente al tratamiento. El control sistemático de la PCR postrasplante permite el diagnóstico y el tratamiento precoces de la reactivación del T. cruzi.
El tratamiento de la enfermedad de Chagas gastrointestinal es similar al de la acalasia idiopática o el megacolon. Los síntomas esofágicos se pueden aliviar con fármacos que relajen el esfínter o por miotomía laparoscópica. Las etapas tempranas de la alteración colónica pueden responder a dietas ricas en fibras y laxantes o enemas. Las etapas tardías del megaesófago y el megacolon quizás necesiten cirugía. El tratamiento antitripanosómico no influye sobre la progresión de la enfermedad de Chagas gastrointestinal.
Conclusiones
La enfermedad de Chagas sigue siendo una causa importante de enfermedad y muerte prematura. Son necesarios mejores tratamientos y estudios rigurosos sobre fármacos para tratar la infección crónica por T. cruzi en los millones de personas que la padecen. Como progreso en los últimos años, se publicaron dos estudios aleatorizados, doble ciego, de nuevos fármacos, y validaron el empleo de métodos moleculares como indicadores oportunos de fracaso terapéutico; la búsqueda de una verdadera prueba de la curación continúa.
A pesar de los progresos en el control de la infección por el vector doméstico desde 1991, quedan algunos desafíos difíciles. Son necesarias nuevas estrategias para las zonas más endémicas, especialmente el Gran Chaco, donde es común la rápida reinfección doméstica y es cada vez más evidente la resistencia a los insecticidas. En zonas con amplia infección selvática, como la cuenca del Amazonas, la eliminación de los vectores es imposible. Es necesario implementar y mantener nuevos métodos para prevenir la transmisión por el vector y por vía oral.
*Traducción y resumen objetivo: Dr. Ricardo Ferreira
Comentario del Editor
En nuestro país (Argentina) se estima que 1.500.000 personas, es decir el 4% de la población, padecen enfermedad de Chagas, cifras que significan un problema de salud pública. La OPS estima que 7-10 millones de personas la padecen en toda América latina.
El insecto vector es el que popularmente se llama “vinchuca”.
Aún no se han demostrado casos de transmisión oral en Argentina.
La producción de benznidazol había sido suspendida por el único laboratorio (multinacional) que lo fabricaba, debido a su falta de rentabilidad, quedando Brasil como productor mundial exclusivo. Tras meses de falta de stock, en 2012 se inició la producción en nuestro país a través del Ministerio de Salud en alianza con un laboratorio privado y una ONG. Actualmente, todos los países de América pueden acceder al principal tratamiento para la enfermedad de Chagas a través del fondo estratégico de la OPS.
*Todos los países de América ya pueden acceder al benznidazol, el medicamento para el tratamiento Chagas, a través de la Organización Panamericana de la Salud.
Referencias
- Bern C. Antitrypanosomal therapy for chronic Chagas’ disease. N Engl J Med 2011; 364: 2527-34.
2. Rassi A Jr, Rassi A, Marin-Neto JA. Chagas disease. Lancet 2010; 375: 1388-402.
3. Shikanai-Yasuda MA, Carvalho NB. Oral transmission of Chagas disease. Clin Infect Dis 2012; 54: 845-52.
4. Rassi A Jr, Rassi A, Marcondes de Rezende J. American tripanosomiasis (Chagas disease). Infect Dis Clin North Am 2012; 26: 275-91.
5. Chagas disease in Latin America: an epidemiological update based on 2010 estimates. Wkly Epidemiol Rec 2015; 90: 33-43.
6. Feliciangeli MD, Campbell-Lendrum D, Martinez C, Gonzalez D, Coleman P, Davies C. Chagas disease control in Venezuela: lessons for the Andean region and beyond. Trends Parasitol 2003; 19: 44-9.
7. Nouvellet P, Dumonteil E, Gourbière S. The improbable transmission of Trypanosoma cruzi to human: the missing link in the dynamics and control of Chagas disease. PLoS Negl Trop Dis 2013; 7(11): e2505.
8. Samuels AM, Clark EH, Galdos- Cardenas G, et al. Epidemiology of and impact of insecticide spraying on Chagas disease in communities in the Bolivian Chaco. PLoS Negl Trop Dis 2013; 7(8): e2358.
9. Maguire JH, Mott KE, Lehman JS, et al. Relationship of electrocardiographic abnormalities and seropositivity to Trypanosoma cruzi within a rural community in northeast Brazil. Am Heart J 1983; 105: 287-94.
10. Bern C, Montgomery SP. An estimate of the burden of Chagas disease in the United States. Clin Infect Dis 2009; 49(5): e52-e54.
11. Gascon J, Bern C, Pinazo MJ. Chagas disease in Spain, the United States and other non-endemic countries. Acta Trop 2010; 115: 22-7.
12. Schofield CJ, Jannin J, Salvatella R. The future of Chagas disease control. Trends Parasitol 2006; 22: 583-8.
13. Hashimoto K, Schofield CJ. Elimination of Rhodnius prolixus in Central America. Parasit Vectors 2012; 5: 45.
14. Global burden of disease estimates for 2000–2012. Geneva: World Health Organization, 2014 (http://www .who .int/healthinfo/ global_burden_disease/estimates/ en/ index2 .html).
15. Bern C, Kjos S, Yabsley MJ, Montgomery SP. Trypanosoma cruzi and Chagas’ disease in the United States. Clin Microbiol Rev 2011; 24: 655-81.
16. Cantey PT, Stramer SL, Townsend RL, et al. The United States Trypanosoma cruzi Infection Study: evidence for vectorborne transmission of the parasite that causes Chagas disease among United States blood donors. Transfusion 2012;52: 1922-30.
17. Garcia MN, Aguilar D, Gorchakov R, et al. Evidence of autochthonous Chagas disease in southeastern Texas. Am J Trop Med Hyg 2015; 92: 325-30.
18. Kapelusznik L, Varela D, Montgomery SP, et al. Chagas disease in Latin American immigrants with dilated cardiomyopathy in New York City. Clin Infect Dis 2013; 57(1): e7.
19. Edwards MS, Rench MA, Todd CW, et al. Perinatal screening for Chagas disease in southern Texas. J Pediatr Infect Dis Soc 2015; 4: 67-70.
20. Stimpert KK, Montgomery SP. Physician awareness of Chagas disease, USA. Emerg Infect Dis 2010; 16: 871-2.
21. Verani JR, Montgomery SP, Schulkin J, Anderson B, Jones JL. Survey of obstetrician- gynecologists in the United States about Chagas disease. Am J Trop Med Hyg 2010; 83: 891-5.
22. Bern C, Montgomery SP, Herwaldt BL, et al. Evaluation and treatment of Chagas disease in the United States: a systematic review. JAMA 2007; 298: 2171-81.
23. Bern C, Martin DL, Gilman RH. Acute and congenital Chagas disease. Adv Parasitol 2011; 75: 19-47.
24. Rassi A Jr, Dias JC, Marin-Neto JA, Rassi A. Challenges and opportunities for primary, secondary, and tertiary prevention of Chagas’ disease. Heart 2009; 95: 524-34.
25. Acquatella H. Echocardiography in Chagas heart disease. Circulation 2007;115: 1124-31.
26. Sabino EC, Ribeiro AL, Salemi VM, et al. Ten-year incidence of Chagas cardiomyopathy among asymptomatic Trypanosoma cruzi-seropositive former blood donors. Circulation 2013; 127: 1105-15.
27. Marin-Neto JA, Cunha-Neto E, Maciel BC, Sim.es MV. Pathogenesis of chronic Chagas heart disease. Circulation 2007; 115: 1109-23.
28. Tarleton RL. Parasite persistence in the aetiology of Chagas disease. Int J Parasitol 2001; 31: 550-4.
29. Dutra WO, Menezes CA, Magalh.es LM, Gollob KJ. Immunoregulatory networks in human Chagas disease. Parasite Immunol 2014; 36: 377-87.
30. Tarleton RL. Chagas disease: a role for autoimmunity? Trends Parasitol 2003;19: 447-51.
31. Machado FS, Dutra WO, Esper L, et al. Current understanding of immunity to Trypanosoma cruzi infection and pathogenesis of Chagas disease. Semin Immunopathol 2012; 34: 753-70.
32. Pinto Dias JC. Natural history of Chagas disease. Arq Bras Cardiol 1995; 65:359-66. (In Portuguese.)
33. Bustamante JM, Rivarola HW, Fernández AR, et al. Trypanosoma cruzi reinfections in mice determine the severity of cardiac damage. Int J Parasitol 2002; 32:889-96.
34. de Oliveira RB, Troncon LE, Dantas RO, Menghelli UG. Gastrointestinal manifestations of Chagas’ disease. Am J Gastroenterol 1998; 93: 884-9.
35. Pinazo MJ, Ca.as E, Elizalde JI, et al. Diagnosis, management and treatment of chronic Chagas’ gastrointestinal disease in areas where Trypanosoma cruzi infection is not endemic. Gastroenterol Hepatol 2010; 33: 191-200.
36. Miles MA, Cedillos RA, Póvoa MM, de Souza AA, Prata A, Macedo V. Do radically dissimilar Trypanosoma cruzi strains (zymodemes) cause Venezuelan and Brazilian forms of Chagas’ disease? Lancet 1981; 1: 1338-40.
37. del Puerto R, Nishizawa JE, Kikuchi M, et al. Lineage analysis of circulating Trypanosoma cruzi parasites and their association with clinical forms of Chagas disease in Bolivia. PLoS Negl Trop Dis 2010; 4(5): e687.
38. Huprikar S, Bosserman E, Patel G, et al. Donor-derived Trypanosoma cruzi infection in solid organ recipients in the United States, 2001-2011. Am J Transplant 2013; 13: 2418-25.
39. Bacal F, Silva CP, Pires PV, et al. Transplantation for Chagas’ disease: an overview of immunosuppression and reactivation in the last two decades. Clin Transplant 2010; 24(2): E29-E34.
40. Sartori AM, Ibrahim KY, Nunes Westphalen EV, et al. Manifestations of Chagas disease (American trypanosomiasis) in patients with HIV/AIDS. Ann Trop Med Parasitol 2007; 101: 31-50.
41. Bocchi EA, Fiorelli A. The paradox of survival results after heart transplantation for cardiomyopathy caused by Trypanosoma cruzi. Ann Thorac Surg 2001;71: 1833-8.
42. Kransdorf EP, Czer LS, Luthringer DJ, et al. Heart transplantation for Chagas cardiomyopathy in the United States. Am J Transplant 2013; 13: 3262-8.
43. Fiorelli AI, Stolf NA, Honorato R, et al. Later evolution after cardiac transplantation in Chagas’ disease. Transplant Proc 2005; 37: 2793-8.
44. Chin-Hong PV, Schwartz BS, Bern C, et al. Screening and treatment of Chagas disease in organ transplant recipients in the United States: recommendations from the Chagas in Transplant Working Group. Am J Transplant 2011; 11: 672-80.
45. Tarleton RL, Reithinger R, Urbina JA, Kitron U, Gürtler RE. The challenges of Chagas Disease — grim outlook or glimmer of hope? PLoS Med 2007; 4(12): e332.
46. Schijman AG, Bisio M, Orellana L, et al. International study to evaluate PCR methods for detection of Trypanosoma cruzi DNA in blood samples from Chagas disease patients. PLoS Negl Trop Dis 2011; 5(1): e931.
47. Duffy T, Bisio M, Altcheh J, et al. Accurate real-time PCR strategy for monitoring bloodstream parasitic loads in Chagas disease patients. PLoS Negl Trop Dis 2009; 3(4): e419.
48. Diez M, Favaloro L, Bertolotti A, et al. Usefulness of PCR strategies for early diagnosis of Chagas’ disease reactivation and treatment follow-up in heart transplantation. Am J Transplant 2007; 7: 1633-40.
49. Molina I, Gómez i Prat J, Salvador F, et al. Randomized trial of posaconazole and benznidazole for chronic Chagas’ disease. N Engl J Med 2014; 370: 1899-908.
50. Chatelain E. Chagas disease drug discovery: toward a new era. J Biomol Screen 2015; 20: 22-35.
51. Pinazo MJ, Muñoz J, Posada E, et al. Tolerance of benznidazole in treatment of Chagas’ disease in adults. Antimicrob Agents Chemother 2010; 54: 4896-9.
52. Coura JR, de Abreu LL, Willcox HP, Petana W. Comparative controlled study on the use of benznidazole, nifurtimox and placebo, in the chronic form of Chagas’ disease, in a field area with interrupted transmission. I. Preliminary evaluation. Rev Soc Bras Med Trop 1997; 30: 139-44. (In Portuguese.)
53. Viotti R, Vigliano C, Lococo B, et al. Long-term cardiac outcomes of treating chronic Chagas disease with benznidazole versus no treatment: a nonrandomized trial. Ann Intern Med 2006; 144: 724-34.
54. Pérez-Molina JA, Pérez-Ayala A, Moreno S, Fernández-González MC, Zamora J, López-Velez R. Use of benznidazole to treat chronic Chagas’ disease: a systematic review with a meta-analysis. J Antimicrob Chemother 2009; 64: 1139-47.
55. Tornheim JA, Lozano Beltran DF, Gilman RH, et al. Improved completion rates and characterization of drug reactions with an intensive Chagas disease treatment program in rural Bolivia. PLoS Negl Trop Dis 2013; 7(9): e2407.
56. Jackson Y, Alirol E, Getaz L, Wolff H, Combescure C, Chappuis F. Tolerance and safety of nifurtimox in patients with chronic Chagas disease. Clin Infect Dis 2010; 51(10): e69-e75.
57. Wegner DH, Rohwedder RW. Experience with nifurtimox in chronic Chagas’ infection: preliminary report. Arzneimittelforschung 1972; 22: 1635-41.
58. Priotto G, Kasparian S, Mutombo W, et al. Nifurtimox-eflornithine combination therapy for second-stage African Trypanosoma brucei gambiense trypanosomiasis: a multicentre, randomised, phse III, non-inferiority trial Lancet 2009; 374: 56-64.
59. Saulnier Sholler GL, Bergendahl GM, Brard L, et al. A phase 1 study of nifurtimox in patients with relapsed/refractory neuroblastoma J Pediatr Hematol Oncol 2011; 33: 25-30.
60. de Andrade AL, Zicker F, de Oliveira RM, et al. Randomised trial of efficacy of benznidazole in treatment of early Trypanosoma cruzi infection. Lancet 1996; 348: 1407-13.
61. Sosa Estani S, Segura EL, Ruiz AM, Velazquez E, Porcel BM, Yampotis C. Efficacy of chemotherapy with benznidazole in children in the indeterminate phase of Chagas’ disease. Am J Trop Med Hyg 1998; 59: 526-9.
62. Altcheh J, Moscatelli G, Mastrantonio G, et al. Population pharmacokinetic study of benznidazole in pediatric Chagas disease suggests efficacy despite lower plasma concentrations than in adults. PLoS Negl Trop Dis 2014; 8(5): e2907.
63. Cancado JR, Brener Z. Terapeutica. In: Brener Z, Andrade Z, eds. Trypanosoma cruzi e doen.a de Chagas. Rio de Janeiro: Guanabara Koogan, 1979: 362-424.
64. Andrade AL, Martelli CM, Oliveira RM, et al. Short report: benznidazole efficacy among Trypanosoma cruzi-infected adolescents after a six-year follow-up. Am J Trop Med Hyg 2004; 71: 594-7.
65. Streiger ML, del Barco ML, Fabbro DL, Arias ED, Amicone NA. Longitudinal study and specific chemotherapy in children with chronic Chagas’ disease, residing in a low endemicity area of Argentina. Rev Soc Bras Med Trop 2004; 37: 365-75.
66. Gascón J, Albajar P, Ca.as E, et al. Diagnosis, management and treatment of chronic Chagas’ heart disease in areas where Trypanosoma cruzi infection is not endemic. Rev Esp Cardiol 2007; 60: 285-93. (In Spanish.)
67. Sosa-Estani S, Segura EL. Etiological treatment in patients infected by Trypanosoma cruzi: experiences in Argentina. Curr Opin Infect Dis 2006; 19: 583-7.
68. Viotti R, Alarcón de Noya B, Araujo-Jorge T, et al. Towards a paradigm shift in the treatment of chronic Chagas disease. Antimicrob Agents Chemother 2014; 58:635-9.
69. Villar JC, Perez JG, Cortes OL, et al. Trypanocidal drugs for chronic asymptomatic Trypanosoma cruzi infection. Cochrane Database Syst Rev 2014; 5: CD003463.
70. Marin-Neto JA, Rassi A Jr, Avezum A Jr, et al. The BENEFIT trial: testing the hypothesis that trypanocidal therapy is beneficial for patients with chronic Chagas heart disease. Mem Inst Oswaldo Cruz 2009; 104: Suppl 1: 319-24.
71. Fabbro DL, Danesi E, Olivera V, et al. Trypanocide treatment of women infected with Trypanosoma cruzi and its effect on preventing congenital Chagas. PLoS Negl Trop Dis 2014; 8(11): e3312.
72. Pinazo MJ, Thomas MC, Bua J, et al. Biological markers for evaluating therapeutic efficacy in Chagas disease, a systematic review. Expert Rev Anti Infect Ther 2014; 12: 479-96.
73. Requena-Méndez A, López MC, Angheben A, et al. Evaluating Chagas disease progression and cure through blood-derived biomarkers: a systematic review. Expert Rev Anti Infect Ther 2013; 11: 957-76.
74. Ribeiro AL, Nunes MP, Teixeira MM, Rocha MO. Diagnosis and management of Chagas disease and cardiomyopathy. Nat Rev Cardiol 2012; 9: 576-89.
75. Gali WL, Sarabanda AV, Baggio JM, et al. Implantable cardioverter-defibrillators for treatment of sustained ventricular arrhythmias in patients with Chagas’ heart disease: comparison with a control group treated with amiodarone alone. Europace 2014; 16: 674-80.
76. Gürtler RE, Kitron U, Cecere MC, Segura EL, Cohen JE. Sustainable vector control and management of Chagas disease in the Gran Chaco, Argentina. Proc Natl Acad Sci U S A 2007; 104: 16194-9.
77. Dias JC. Elimination of Chagas disease transmission: perspectives. Mem Inst Oswaldo Cruz 2009; 104: Suppl 1: 41-5.